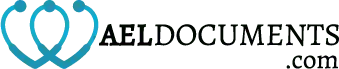\title{
Dosage acido-basique \ Questions-Réponses WaelDocuments
}
- Introduction:
- Remarque importante:
Le réactif titrant doit être fort. C’est à dire on dose toujours avec un acide fort ou une base forte.
- Les cas possibles (4 cas).
- Acide fort avec base forte
- Acide faible avec base fort
- Base forte avec acide fort
- Base faible avec acide fort

\section*{AELDOCUMENTS}
\section*{I- Dosage d’un acide fort ( $\mathrm{HCl}$ ) par une base forte ( $\mathrm{NaOH}$ )}
\section*{1. Donner l’allure de la courbe de $\mathrm{pH}=\mathrm{f}(\mathrm{Vb})$}
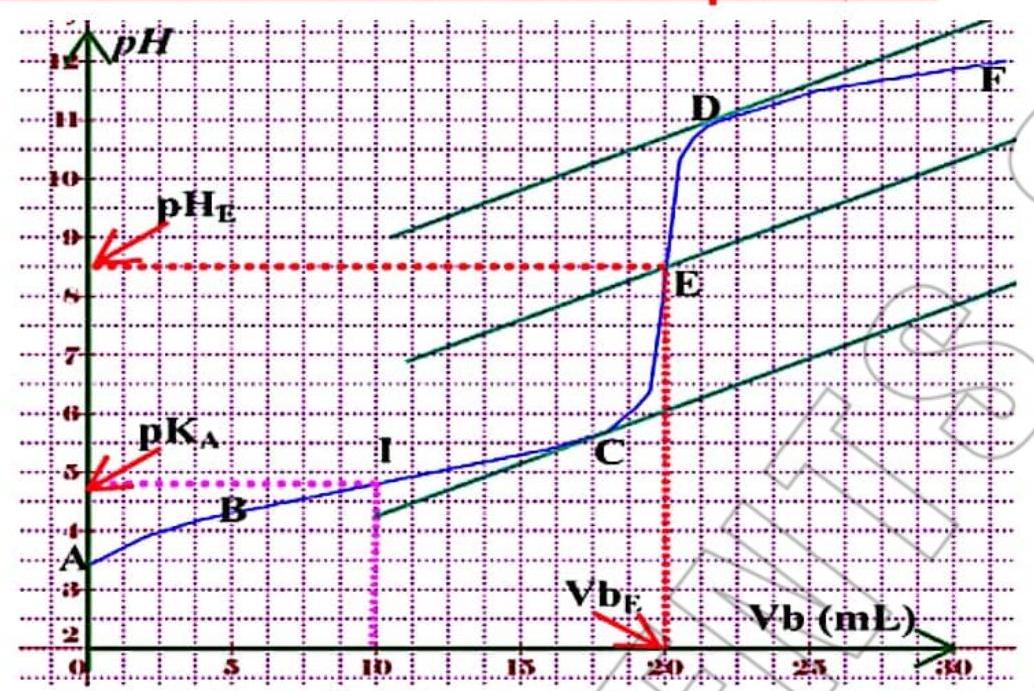
2- Montrer que c’est le dosage d’un acide fort
$*\left{\begin{array}{l}p H_{i}<7 \\ p H_{E}=7 \\ p E_{f}>7\end{array}\right.$
on bien

- La courbe possède un seulpoint d’inflexion.
$\Rightarrow$ dosoge d’un acide fort.
\section*{3.Donner l’équation de la réaction du dosage.}
$$
\mathrm{H}{3} \mathrm{O}^{+}+\mathrm{OH}^{-} \rightarrow 2 \mathrm{H}{2} \mathrm{O}
$$
- La Réaction du dosage est totale.
4 – Définir l’équivalence acido-basique.
c’est l’état du mélange lorsque la quantité de l’acide et la quantité de la base sont en proportion stoechiométrique, visitez notre page facebook WaelDocuments.com
$$
\begin{aligned}
& \Rightarrow n \text { (acide) introduit }=n \text { (base) ajouté } \
& \Rightarrow n_{A}=n \text { b } \
& \Rightarrow C_{A} V_{A}=C_{B} V_{B E} \Rightarrow C_{A}=\frac{C_{B} V_{B E}}{V_{A}}
\end{aligned}
$$
يمكنكم شراجعة بالوريا جميع الشعب جميع المواد على صفتنا
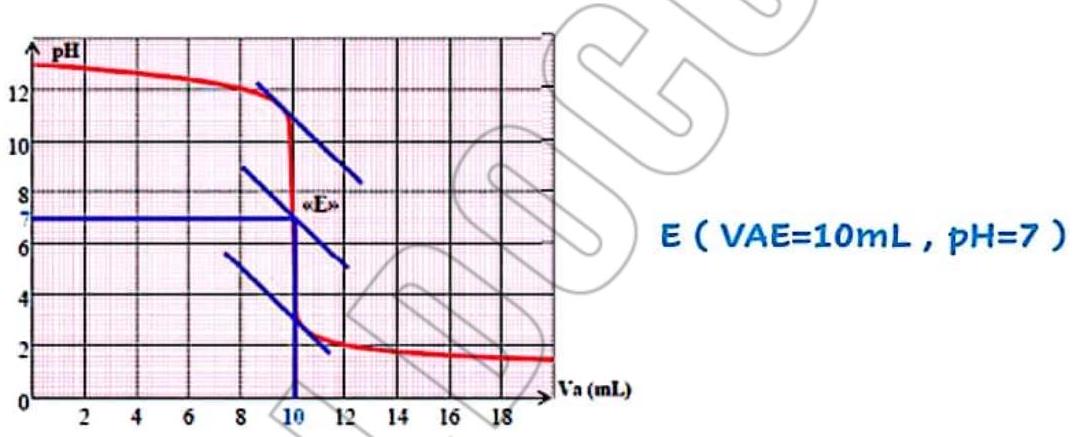
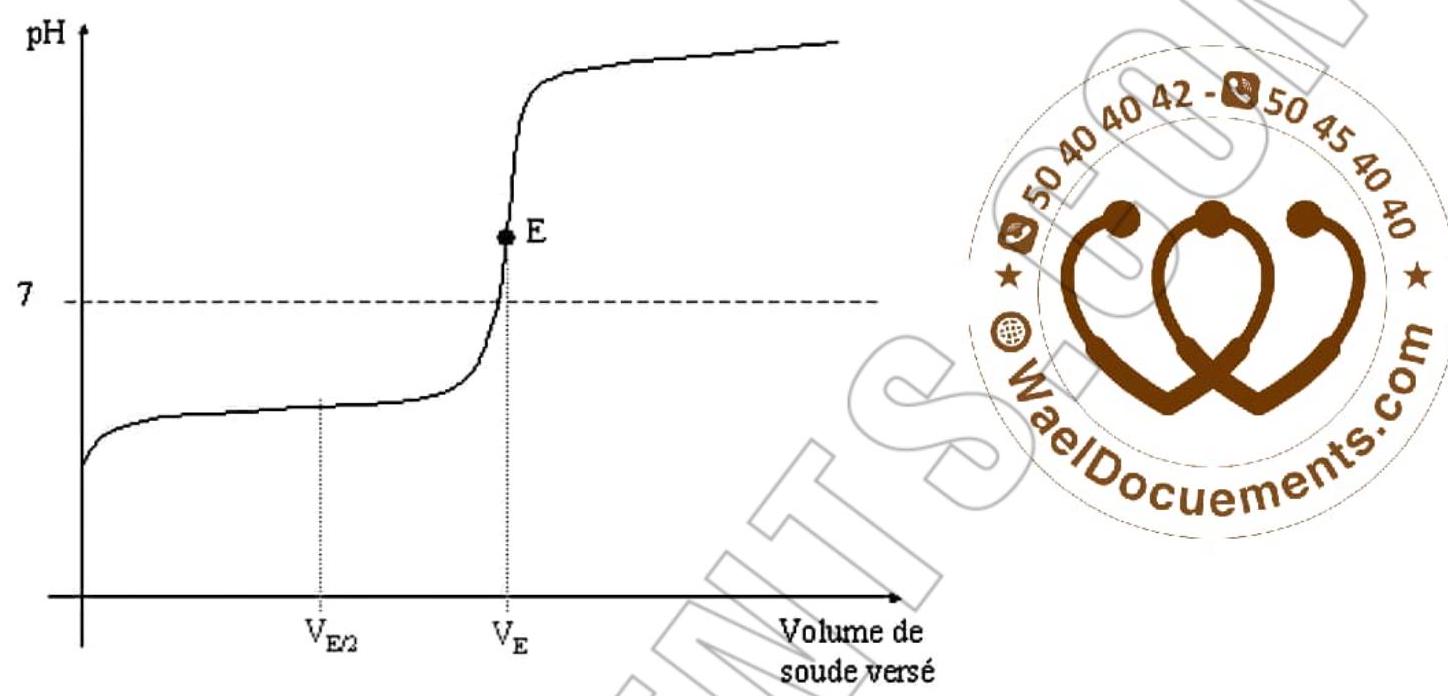
5 – Déterminer graphiquement les coordonnées du point d’équivalence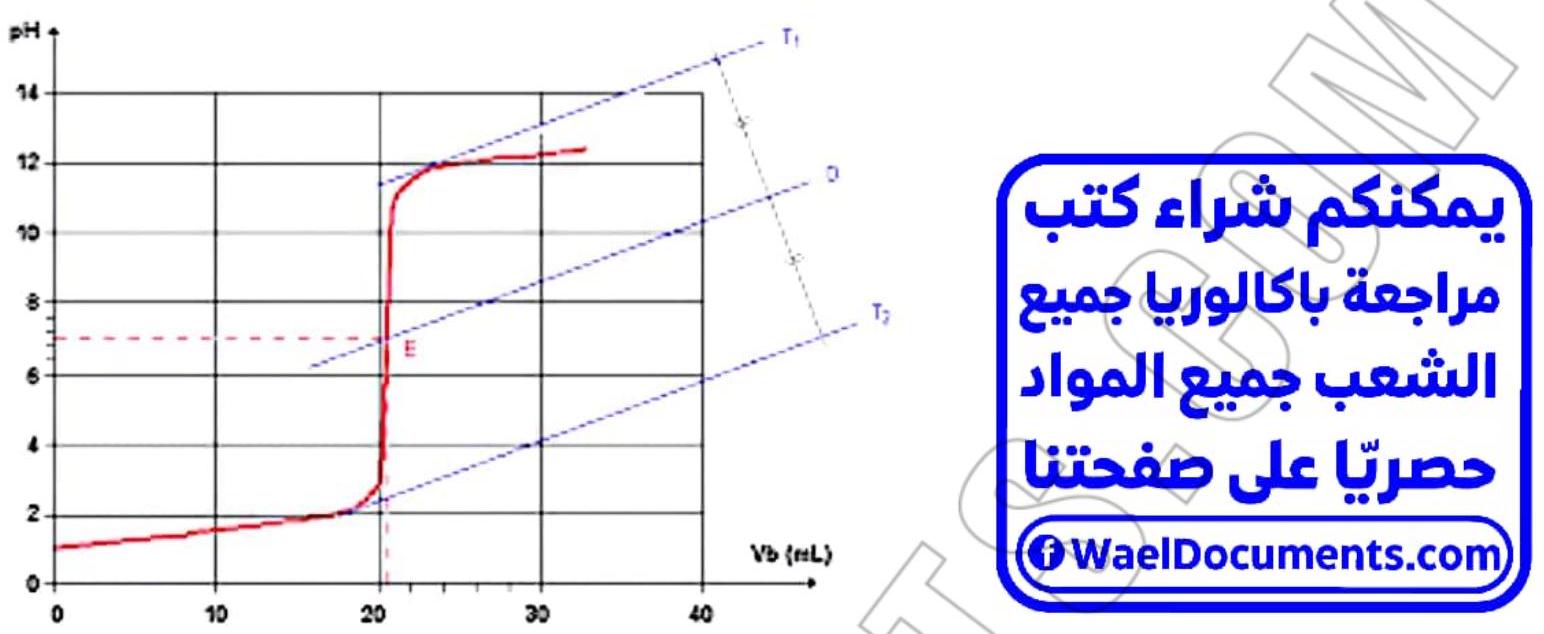
$\mathrm{E}(\mathrm{pH}, \mathrm{Vb})$
- (VBE=20 mL, $\mathrm{PHE}=7)$
\section*{6. Influence de la dilution:}
- pHi augmente
- $\quad \mathrm{pH}{E}$ reste le meme $\mathrm{pH}{E}=7$.
- $\mathrm{PH}_{f}$ diminue
- VBE reste le même.
\section*{II – Dosage d’une base forte par un acide fort.}
1- Donner l’allure de la courbe de $\mathrm{pH}=\mathrm{f}(\mathrm{VA})$
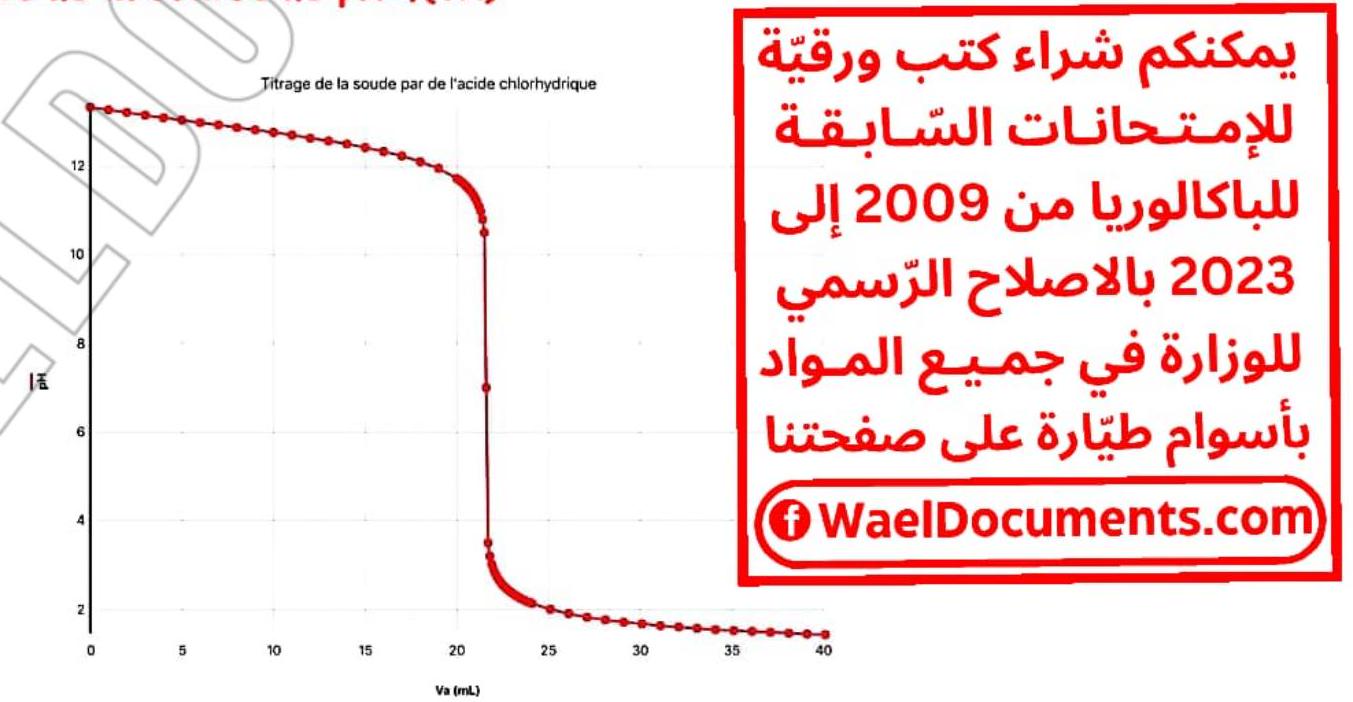
2- Montrer que c’est le dosage d’un acide fort
- $\left{\begin{array}{l}p H_{i}>7 \ p H_{E}=7 \ p E_{f}<7\end{array}\right.$
on bien
- La courbe possède un seul point d’inflextion.
$\Rightarrow$ dosage d’une base forte

- Donner l’équation de la réaction du dosage.
$$
\mathrm{H}{3} \mathrm{O}^{+}+\mathbf{O H}^{-} \rightarrow 2 \mathrm{H}{2} \mathrm{O}
$$
4.Equivalence acido-basique:
$$
\begin{aligned}
n_{A} & =n_{B} . \
C_{A} V_{A E} & =C_{B} V_{B} \
\Rightarrow C_{B} & =\frac{C_{A} V_{A E}}{V_{B}}
\end{aligned}
$$
5- Déterminer graphiquemeut les coordonnées du point d’équivalence:
\section*{6. Influence de la dilution:}
- pHfaugmente
- $P H_{E}$ reste le même $\mathrm{pH}_{E}=7$.

- $\mathrm{pH}_{\mathrm{i}}$ diminue
- VAE reste le même
\section*{III – Dosage d’un acide faible par une base forte:}
1 – Donner l’allure de la courbe du pH=f(Vb)
\section*{2- Montrer que c’est le dosage d’un acide faible}
- $\left{\begin{array}{l}P H_{i}<7 \\ p H_{E}>7 \ p E_{f}>7\end{array}\right.$
ou bien
- La courbe présente 2 points d’inflexion de notre page instagram @WaelDocuments $\Rightarrow$ dosage d’un acide faibe.
\section*{3. Donner l’équation de la réaction du dosage.}
$$
\mathrm{AH}+\mathbf{O H}^{-} \rightarrow \mathrm{A}^{-}+\mathrm{H}_{2} \mathbf{O}
$$
exemple d’un acide faible:
$$
\mathrm{CH}{3} \mathrm{COOH}+\mathrm{OH}^{-} \rightarrow \mathrm{CH}{3} \mathrm{COO}^{-}+\mathrm{H}_{2} \mathrm{O}
$$

\section*{4 – Déterminer le caractère acido-basique de la solution à l’équivalence}
- $p \mathrm{H}{E}=8,7>7 \Rightarrow$ le milien est basique dù à $\mathrm{CH}{3} \mathrm{COO}$ – base faible conjuguée de $\mathrm{CH}_{3} \mathrm{COOH}^{2}$ quil réagit avec l’eau selon l’équation suivante:
$$
\mathrm{CH}{3} \mathrm{COO}^{-}+\mathrm{H}{2} \mathrm{O} \rightleftharpoons \mathrm{CH}_{3} \mathrm{COOH}+\mathrm{OH}^{-}
$$
cette réaction augmente $\left[\mathrm{OH}^{-}\right]$d’ou le caractère basique du mélange
\section*{5 – Déterminer l’expression du pH à la demi- équivalence}
$$
\begin{aligned}
& \mathrm{CH}{3} \mathrm{COH}+\mathrm{H}{2} \mathrm{O} \rightleftharpoons \mathrm{CH}{3} \mathrm{COO}^{-}+\mathrm{H}{3} \mathrm{O}^{+} \
& \Rightarrow \mathrm{Ka}=\frac{\left[\mathrm{CH}{3} \mathrm{COO}^{-}\right]\left[\mathrm{H}{3} \mathrm{O}^{+}\right]}{\left[\mathrm{CH}_{3} \mathrm{COOH}\right]}
\end{aligned}
$$
- A la demi-équivalence $\left[\mathrm{CH}{3} \mathrm{COOH}\right]=\left[\mathrm{CH}{3} \mathrm{COO}-\right]$
$$
\begin{aligned}
& \Rightarrow K_{a}=\left[\mathrm{H}{3} \mathrm{O}^{+}\right] \ & \Rightarrow-\log \mathrm{Ka}=-\log \left[\mathrm{H}{3} \mathrm{O}^{+}\right] \
& \Rightarrow p \mathrm{Ka}=\mathrm{pH} .
\end{aligned}
$$
Remarque:
- A la démi-équivalence $V_{B}=\frac{V_{B E}}{2}$.
\section*{6 – Influence de la dilution:}
- pHi augumente
- pHf diminue

- VBE ne change pas
- $\mathrm{PH}_{E}$ diminue
- $p H\left(E_{1 / 2}\right)$ reste inchangée car $p H_{E_{1}}=p K a=$ cte.
\section*{7 – Montrer que la réaction du dosage est totale:}
$$
\begin{aligned}
& \mathrm{CH}{3} \mathrm{COOH}+\mathrm{OH}^{-} \rightarrow \mathrm{CH}{3} \mathrm{COO}^{-}+\mathrm{H}{2} \mathrm{O} \ & K=\frac{\left[\mathrm{CH}{3} \mathrm{COO}^{-}\right]{e q} \times\left[\mathrm{H}{3} 0^{+}\right]}{\left(\mathrm{CH}{3} \mathrm{COOH}\right]{e q}\left[\mathrm{OH}^{-}\right]{e q} \times\left[\mathrm{H}{3} \mathrm{O}^{-}\right]}
\end{aligned}
$$
$$
\Rightarrow K=\frac{K_{a}}{K_{e}}=\frac{10^{-p K_{a}}}{10^{-p K e}}=10^{p K_{e}-p^{K_{a}}}
$$
$$
\begin{aligned}
& =10^{14-5} \
& =10^{9}>10^{4}
\end{aligned}
$$
$\Rightarrow$ la Réaction du dosage est totale.

\section*{IV – Dosage d’une base faible par un acide fort.}
1- Donner l’allure de la courbe du $\mathrm{pH}=\mathrm{f}(\mathrm{Vb})$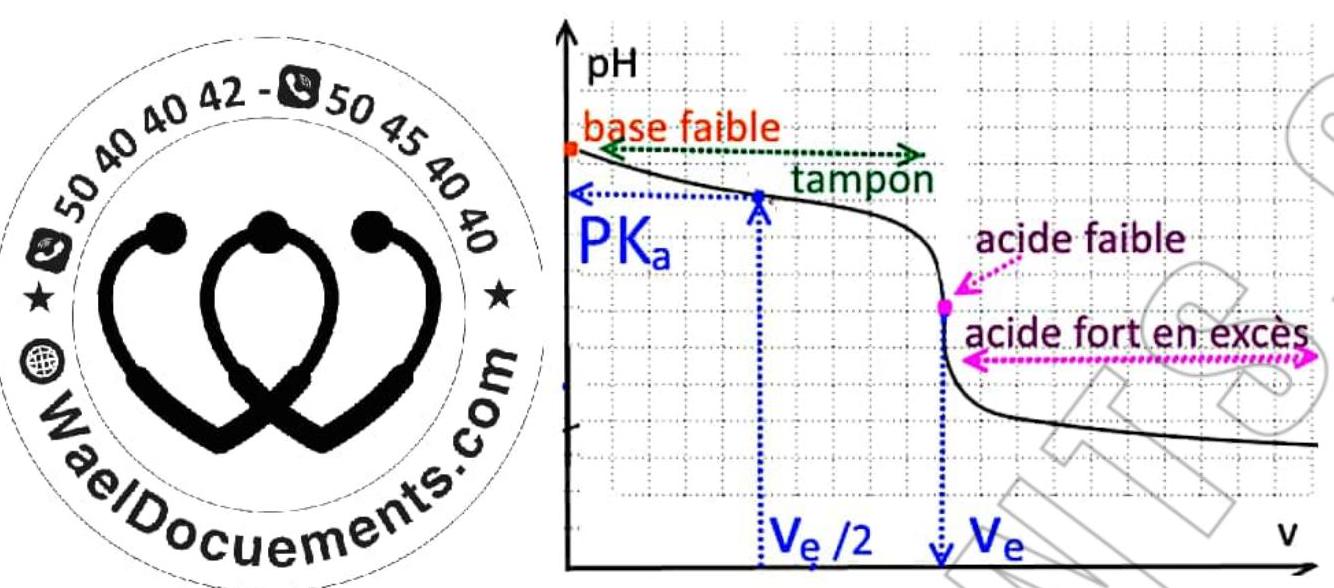
\section*{2- Montrer que c’est le dosage d’un acide faible}
- $\left{\begin{array}{l}p H_{i}>7 \ p H_{E}<7 \ p E_{f}<7\end{array}\right.$
ou bien
\section*{AELDOCUMENTS}
- La courbe présente 2 points d’inflexion $\Rightarrow$ dosage d’une base faible. Donc dosage d’une base faible
3- Donner l’équation de la réaction du dosage.
$$
\mathrm{B}+\mathrm{H}{3} \mathrm{O}^{+} \rightarrow \mathrm{BH}^{+}+\mathrm{H}{2} \mathrm{O}
$$
Exemple d’une base faible.
$$
\mathrm{NH}{3}+\mathrm{OH}^{-} \rightarrow \mathrm{NH}{4}^{+}+\mathrm{H}_{2} \mathrm{O}
$$

- $p H_{E}=6<7 \Rightarrow$ le milien est acide dû à $\mathrm{NH}{4}^{+}$aade faible conjugué de $\mathrm{NH}{3}$ qui réagit avec Yeau:
$$
\mathrm{NH}{4}^{+}+\mathrm{H}{2} \mathrm{O} \rightleftharpoons \mathrm{NH}{3}+\mathrm{H}{30^{+}}
$$
cette réaction angumente $\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]$d’ou le caractère acide du mélange
\section*{5 – Déterminer l’expression du pH à la demi- équivalence}
$$
\begin{aligned}
& \mathrm{NH}{4}^{+}+\mathrm{H}{2} \mathrm{O} \rightleftharpoons \mathrm{NH}{3}+\mathrm{H}{3} \mathrm{O}^{+} \
& \Rightarrow \mathrm{Ka}=\frac{\left[\mathrm{NH}{3}\right]\left[\mathrm{H}{3} \mathrm{O}^{+}\right]}{\left[\mathrm{NH}_{4}^{+}\right]}
\end{aligned}
$$
A la démi-équivalence $\left[\mathrm{NH}{3}\right]=\left[\mathrm{NH}{4}^{+}\right]$
$$
\begin{aligned}
& \Rightarrow K_{a}=\left[\mathrm{H}{3} 0^{+}\right] \ & \Rightarrow-\log k a=-\log \left[\mathrm{H}{3} 0^{+}\right] \
& \Rightarrow P K a=p H
\end{aligned}
$$
\section*{6 – Influence de la dilution:}
- $p H_{\mathrm{i}}$ diminue
- PHf angumente
- $p H_{E_{1 / 2}}$ reste inchangé car $p H_{E_{1 / 2}}=p K_{a}=c t e$
- $\mathrm{PH}_{E}$ angumente
- VAE reste inchangé
\section*{7 – Montrer que la réaction du dosage est totale:}
$$
\begin{gathered}
\mathrm{NH}{3}+\mathrm{H}{3} \mathrm{O}^{+} \rightarrow \mathrm{NH}{4}^{+}+\mathrm{H}{2} \mathrm{O} \
K=\frac{\left[\mathrm{NH}{4}^{+}\right]{4}}{\left[\mathrm{NH}{3}\right]{4}\left[\mathrm{H}{3} \mathrm{O}^{+}\right]{4}} \
=\frac{1}{K a}=\frac{1}{10^{-p K a}} \
\Rightarrow K \quad K 10^{p \mathrm{Ka}}=10^{9}>10^{4}
\end{gathered}
$$
$\Rightarrow$ la Réaction du dosage est tatale.

\section*{AELDOCUMENTS}
.com
\section*{Astuces:}
- Determiner l’expression du pH dans les points particuliers:
- Dosage d’un acide fort par une base forte:
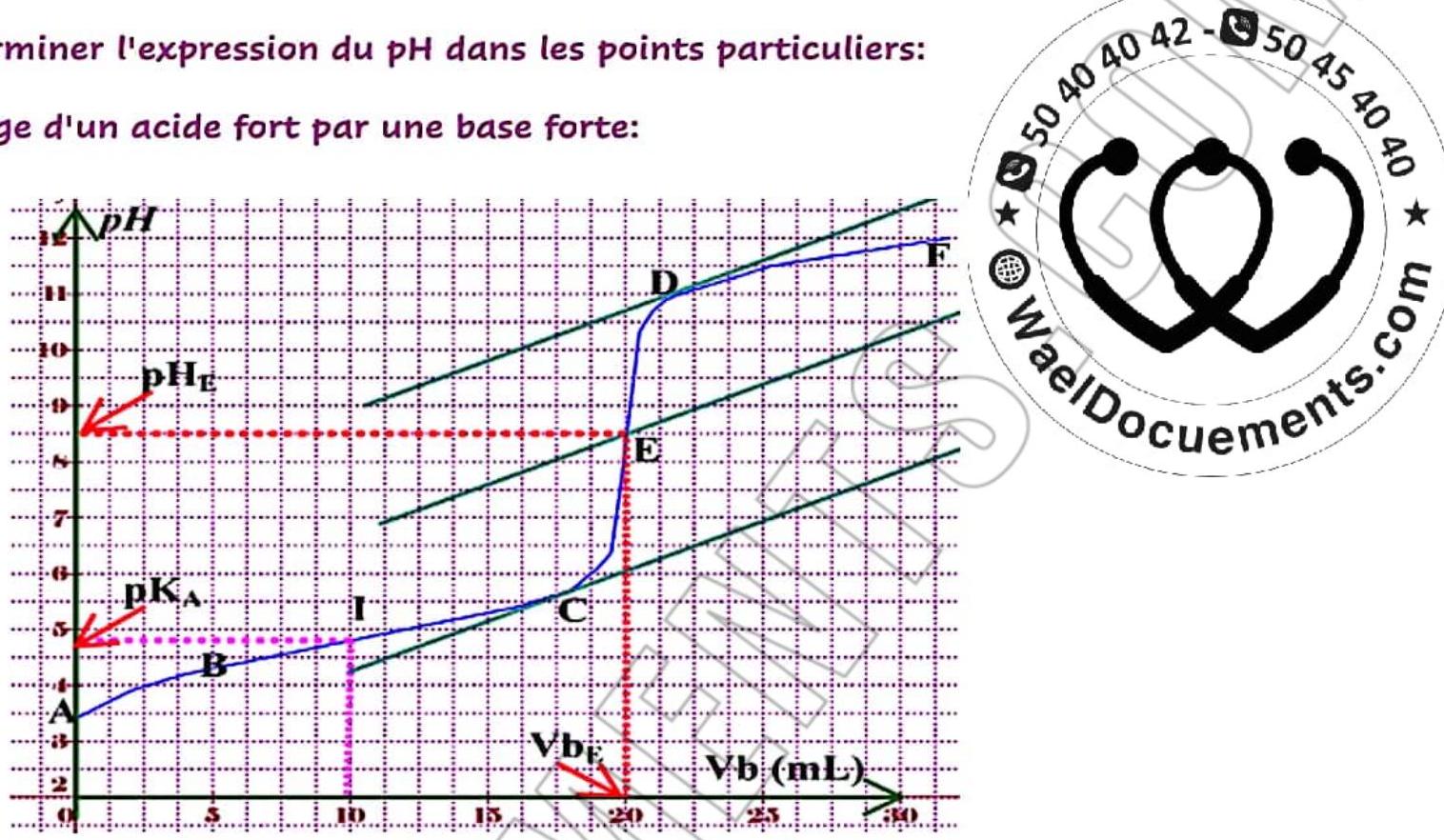
- Initialement, on a un acide fort
$$
p H_{i}=-\log C_{A} .
$$
- A l’équivalence le milien est neutre:
$$
P H_{E}=7 .
$$
- Finalement on a une base forte.
$$
p H_{f}=p K_{e}+\log C .
$$
\section*{AELDOCUMENTS}
.com
- Dosage d’une base forte par un acide fort:
- Initialement on a une base forte:
$$
p H_{i}=p K e+\log \mathrm{C}
$$
- A l’équivalence le milieu est neutre:
$$
P H_{E}=7 \text {. }
$$
- Finalement on a un acide fort:
$$
p H_{f}=-\log \mathrm{C} .
$$
avec:
$$
C=\frac{C_{A} v_{A}-C_{B} v_{B}}{v_{A}+v_{B}}
$$







ماكش باش تلقى أحسن من كتب المراجعة متع WaelDocuments.com – طبعة واضحة

livraison à domicile $7 \mathrm{dt}$

WaelDocuments
 \ شنوّا فيهم الكتب ؟} للكتب قبل ما تشري
\ شنوّا فيهم الكتب ؟} للكتب قبل ما تشري

*المناظرات السابقة للباكالوريا 2009-2023 (الأعوام الكل مصلّحة)
- زوروا موقعنا: www.WaelDocuments.com – أو ابعثولنا message privé ألى صفحتنا على الفايسبوك أو الانستغرام. اسم الصفحة: WaelDocuments.com – أو إتّصلوا بأرقامنا: 50404042 أو 50454040

ماكش باش تلقى أحسن من الكتب متع

- مرفوقة بالإصلاح


livraison à domicile $7 \mathrm{dt}$ للكتب قبل ما تشري

- زوروا موقعنا: www.WaelDocuments.com – أو ابعثولنا message privé على صفحتنا على الفايسبوك أو الانستغرام. اسم الصفحة: WaelDocuments.com – أو إ